Evaluation of Gamavit effectiveness for correction of renal anemia in cats with chronic kidney disease:a controlled randomized study
Леонард Р.А., к.в.н, президент НАВНУ, главный ветврач клиники «Доберман» г. Челябинск;
Зарипова Т.Е., главный ветврач клиники «ОРИКС» г. Москва – ответственная за связь с редакцией;
Балахонов А.Н., ветврач клиники «Доберман» г. Челябинск;
Вдовина Н.Ю. , фельдшер клиники «Доберман» г. Челябинск,
Наровлянский А.Н., д.б.н., профессор ФГБУ «ФНИЦЭМ им.Н.Ф.Гамалеи» Минздрава России,
Пронин А.В., д.б.н., профессор ФГБУ «ФНИЦЭМ им.Н.Ф.Гамалеи» Минздрава России,
Санин А.В., д.б.н., профессор ФГБУ «ФНИЦЭМ им.Н.Ф.Гамалеи» Минздрава России
Ключевые слова: хроническая болезнь почек, анемия, эритропоэз, гематокрит, гамавит, креатинин, кошки
Keywords: chronic kidney disease, anemia, erythropoiesis, hematocrit, gamavit, creatinine, cats
Сокращения: в/в – внутривенно, Д0 – день 0, КИ – клиническое исследование, п/к – подкожно, ХБП - хроническая болезнь почек, ЭПО – эритропоэтин,Hb – гемоглобин.
Введение
Ренальная анемия – одно из многочисленных осложнений хронической болезни почек (ХБП) у кошек, значимо снижающее качество жизни животных [14]. Анемию выявляют примерно у 30-65% кошек с ХБП[30].
Чаще всего механизмы развития и стойкости ренальной анемии связывают с недостаточностью эндогенного эритропоэтина (снижениемего выработкипочками, или уменьшением активности его рецепторных взаимодействий), или с сокращением срока жизни эритроцитов, во многом обусловленном уремической интоксикацией [14, 33, 35].
Анемия неизбежно приводит к развитию гипоксии тканей и органов, а также к снижению общей и специфической резистентности организма, при этом особенно серьезно страдают от гипоксии почки, так как процессы реабсорбции в их канальцевом аппарате требуют больших затрат кислорода и энергии. Таким образом, анемия приводит к усугублению тяжести ренальной гипертензии и других симптомов ХБП. Это обусловливает актуальность поиска эффективных лекарственных средств, способных влиять на качественные и количественные показатели эритропоэза и при этом не обладающих нефротоксическими свойствами[13, 31].
Коммерческие препараты на основе эритропоэтинов, видоспецифических для собак и кошек, до сих пор не разработаны, а рекомбинантные эритропоэтины, помимо высокой стоимости, обладают значительной реактогенностью [14, 32, 34, 39].Побочные эффекты включают рвоту, гипертензию, судорожные припадки и лихорадку [30].
В связи с этим, цель работы состояла в изучении эффективности подключения к схеме лечения кошек с ХБП Гамавита – комплексного отечественного препарата, действующими веществами которого являются иммуностимулятор - нуклеинат натрия и экстракт плаценты денатурированной. Гамавит применяютв ветеринарии для повышения резистентности организма [1,7,8,24,28], коррекциианемии [1,22,23,26,27],восстановления биохимических параметров крови при паразитарных инвазиях [1,8,12,17,26], детоксикации [ 9, 10,15,16,18,19,21,25] и иных целей [5,6,9,20 ].
Материалы и методы
Исследование проводили в период с 14.01.2020 по 25.02.2020 на базе стационара ветеринарной клиники «Доберман» (г. Челябинск).
Целевые животные
Коты и кошки разных пород с ХБП III-IV стадии по классификации IRIS, сопровождающейся анемией и снижением показателя гематокрита от 25 и до 16%.
Критерии включения животных в исследование:
- ХБП* III-IV стадии по классификации IRIS
- снижение показателя гематокрита от 25 и до 16%
- стабильное состояние (на фоне стандартной нефропротективной терапии) в течение не менее 1 недели
- возраст от 5 до 16 лет включительно
*Диагноз ХБП ставили на основании результатов неинвазивных методов диагностики: биохимического анализа крови, общеклинического анализа мочи и УЗИ.
Формирование групп. Распределение животных по группам
Для проведения клинического исследования (КИ) сформированы две группы целевых животных: опытная (n=10) и контрольная (n=10).
Распределение целевых животных по группам выполнено в случайном порядке. Для обеспечения равномерного распределения животных по группам использован метод блочной рандомизации.
Распределение по группам происходило сразу после включения животного в исследование.
Схема лечения (стандартная нефропротективная терапия) в группах:
1.Схема лечения в контрольной группе (стандартный протокол):
Препарат | Цель использования | Доза | |
Нефропротекция | |||
Телмисартан (Микардис, Семинтра) | Блокатор рецепторов ангиотензина. Контроль гиперактивности РААС, вазодилятация первичной микро капиллярной сети почек, ангиопротекция, нефропротекция | Внутрь 1 мг/кг 1 раз в сутки, 42 дня | |
Сулодексид+дерматан сульфат (ВесселДуэФ, Ангиофлюкс) | Ангиопротекция, улучшение реологических свойств крови, нефропротекция | Раствор 300 ЛЕ/мл: 0,3 мл п/к или в/в 1 раз в сутки, 42 дня | |
Торасемид (Диувер, Тригрим) | Профилактика застойных явлений в организме (гидроторакс, гидроперикард), контроль гиперактивности РААС (свойства и АПФ), умеренное форсирование диуреза | Внутрь 0,625 мг/кг 1 раз в 48 часов, 42 дня | |
Севеламер (Ренагель, Селамирекс) | Блокада всасывания фосфора в кишечнике. Контроль Са/Р обмена, компенсированной и декомпенсированой гиперфосфатемии. Косвенно - гиперпаратиреоза | Табл. 800 мг: по ¼ табл. внутрь 3 раза в сутки, 42 дня | |
Парикальцитол (Земплар) | Блокатор кальциевых рецепторов паращитовидной железы. Контроль гипефункции паращитовидной железы, нивелирование действия паратгормона (ведущий «уремический» токсин) на свои рецепторы 1 типа (костная ткань) и 2 типа (большинство иных тканей организма) | 1 мкг/животное внутрь 1 раз в 72 часа, 42 дня | |
Прочие препараты | |||
Дисоль или 4% раствор или гидрокарбонат натрия | Профилактика/терапия метаболического ацидоза и гиповолемии | 15-25 мл/кг в/в симптоматически 1-2 раза в сутки | |
Нефротект + Липофундин 10% | Раствор аминокислот и жиров для парентерального питания | 10-15/15-20 мл/кг симптоматически при анорексии | |
Пантопрозол (Нольпаза) | Профилактика/лечение уремического гастрита | Симптоматически 20 мг/животное внутрь или в/в 1 раз в сутки | |
Метоклопрамид (Церукал) | Противорвотный и прокинетический препарат | Симптоматически в/в, п/к 0,625 мг/кг или 1 мг/кг внутрь 2-3 раза в сутки симптоматически | |
Прамипексол (Мирапекс 0,25 мг) | Дофаминомиметик (агонист дофаминовых рецепторов). (Дефицит дофамина является одной из ведущих причин развития хронического дистресса и экзогенной дипрессии у кошек.) | 0,03-0,05 мг/кг 1-4 раза в сутки симптоматически для стресснеустойчивых животных | |
Рацион: PurinaCatChowAdult с курицей/индейкой/лососем | |||
Особые условия:
Условия кормления и содержания животных опытной и контрольной групп были идентичными. Для кормления использовали стандартизированный серийный корм – PurinaCatChowAdult с курицей/индейкой/лососем. Доступ к питьевой воде – adlibitum.
- Схема лечения в опытной группе:
Эффективность препарата «Гамавит®, раствор для инъекций 10 мл» оценивали в сравнении со стандартной схемой нефропротективной терапии.Препарат вводили в дозе 0,5 мл/кг 1 раз в сутки, в одно и то же время, дополнительно к стандартному протоколу. Общий курс составил 14 дней (7 дней в/в и 7 дней п/к).
Оценка общего клинического состояния
Показатели: общее состояние, активность, аппетит, гидратация кожного покрова, качество шерстного покрова, наличие уремического поражения кожи, изменения глазного дна.
Общеклинический анализ крови
Забор проб крови для общеклинического анализа проводили перед началом лечения (на момент включения в КИ, Д0, 0), затем на 14 (Д14), 28 (Д28) и 42 (Д42) дни после начала лечения согласно плану КИ.
Исследование выполнено в лаборатории ветеринарной клиники «Доберман», г. Челябинск, с использованием гематологического анализатора WML-420B (WondconPetsDivision, Китай, 2018 года выпуска).
Базовые биохимические показатели крови
Забор проб крови для биохимического анализа проводили перед началом лечения (на момент включения в КИ, Д0), затем на 42 (Д42) день после начала лечения согласно плану КИ.
Забор и отправка проб крови проведены согласно стандартным правилам. Биохимическое исследование выполнено в лаборатории ветеринарной клиники «Доберман», г. Челябинск, с использованием биохимического анализатора BioChemSA (HTI ,США, 2013 года выпуска).
Ультрасонографическое исследование
Ультрасонографическое исследование проводили для исключения макроструктурных изменений почек и мочевого пузыря однократно до начала лечения, с использованием аппарата УЗИ Diagnosticultrasoundsystems 2200V, HDI-Lim, США, 2013 года выпуска
Критерии оценки терапевтической эффективности
По окончании исследования оценка терапевтической эффективности проводилась комплексно с учетом данных клинического осмотра, результатов общего и биохимического анализов крови. Дополнительно оценивали наличие побочных эффектов.
Оценка общего клинического состояния: отсутствие новых осложнений ХБП (появление дегидратации, изменение качества шерсти, астения, анорексия, астения, парез задних конечностей, гидроторакс, гидроперикард, значительное ухудшение состояния глазного дна, кровоизлияния в переднюю камеру глаза, галитоз), отсутствие усугубления уже имеющихся признаков.
- Изменения в анализах крови:
- стабилизация/редукция уровня азотемии
- нормализация показателей красной крови относительно исходных значений.
Статистический анализ данных
Статистический анализ данных проведен с использованием программы IBM SPSS statistic 26 общепринятыми методами. Для анализа показателей использован многомерный дисперсный анализ ANOVA (линейная модель с повторными измерениями). При межгрупповом сравнении использован критерии Манна-Уитни. Результаты в таблицах представлены как среднее ± стандартная ошибка среднего (M ± m). Различия между группами считаются статистически значимыми, если значение р не превысит 0,05, а наблюденная мощность будет не ниже 80%.
Результаты и обсуждение
Для проведения исследования предварительно было отобрано 20 кошек с диагнозом ХБП III-IV стадии по классификации IRIS с анемией. Диагноз был поставлен комплексно на основании анамнеза, данных клинического осмотра с учетом результатов не инвазивных методов исследования. Исключенных из исследования кошек не было. На момент включения в исследование все животные получали стандартную нефропротективную терапию в течение не менее 1 недели.
Общее состояние
Общее состояние пациентов на протяжении всего периода наблюдений было стабильным. Значимого ухудшения во время лечения не отмечено ни у одного из них. При первичном осмотре, у части животных отмечали ухудшение качества кожи и шерсти, признаки уремического дерматита (в том и другом случае, являющиеся, предположительно, следствием гиперпаратиреоза) и поражения глазного дна (следствие системной гипертензии).
В ходе исследования у пациентов опытной группы вышеописанные клинические проявления становились менее выраженными или, по крайней мере, не ухудшались.
Результаты УЗИ - исследования
При проведении ультрасонографии почек в опытной и контрольной группах были выявлены структурные изменения почек от средней до тяжелой степени (УЗИ признаки нефросклероза 3-4 степени). Значимых изменений после проведения исследования в обеих группах зафиксировано не было.
Результаты исследования.
Таблица 1. Результаты исследования уровня эритроцитов в крови у животных опытной и контрольной групп
Table 1. Levels of red blood cells in the blood of experimental and control animals
Кол-во эритроцитов | Норма | Опытная (n=10) | Контрольная (n=10) | Значимость, Р ANOVA/ Манна-Уитни |
Д0 (1) | 5,60-10,00*1012 /л | 5,680±0,512 | 5,220±1,059 | 0,001/0,075 |
2 недели (Д14) | 7,140±1,495 | 5,230±1,277 | 0,001/0,005 | |
4 недели (Д28) | 7,660±1,420 | 5,260±1,356 | 0,001/0,002 | |
6 недель (Д42) | 7,990±1,038 | 5,240±1,256 | 0,001/0,000 |
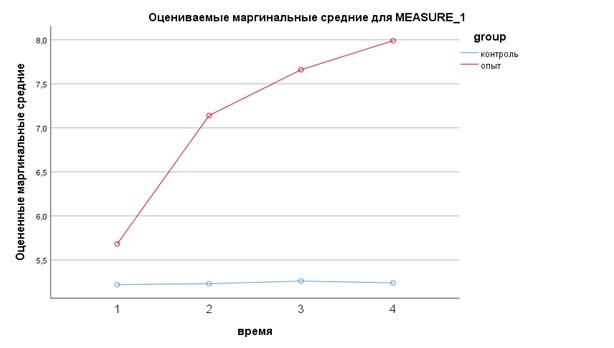
Исходный уровень эритроцитов в опытной и контрольной группе (Д0) был на нижней границе нормы либо ниже референсных значений; согласно показателю критерия Манна-Уитни различия в группах незначимы. В ходе эксперимента у животных опытной группы уже через 2 недели данный показатель пришел в норму, тогда как в контрольной группе существенных изменений не было. Статистически значимая разница между опытной и контрольной группами сохранялась до конца наблюдения (р=0,001). При этом наблюденная мощность многомерного критерия время*группа составила 97,9%.
Таблица 2. Результаты исследования показателя гематокрита в крови у животных опытной и контрольной групп
Table 2. Hematocrit index in the blood of experimental and control animals
Гематокрит | Норма | Опытная (n=10) | Контрольная (n=10) | Значимость, Р ANOVA/ Манна-Уитни |
Д0 (1) | 29,0…48,0 % | 22,700±1,215 | 22,880±0,892 | 0,001/0,853 |
2 недели (Д14) | 32,180±9,151 | 22,430±1,153 | 0,001/0,052 | |
4 недели (Д28) | 37,02±7,851 | 21,720±2,989 | 0,001/0,000 | |
6 недель(Д42) | 36,250±8,364 | 21,340±2,892 | 0,001/0,000 |
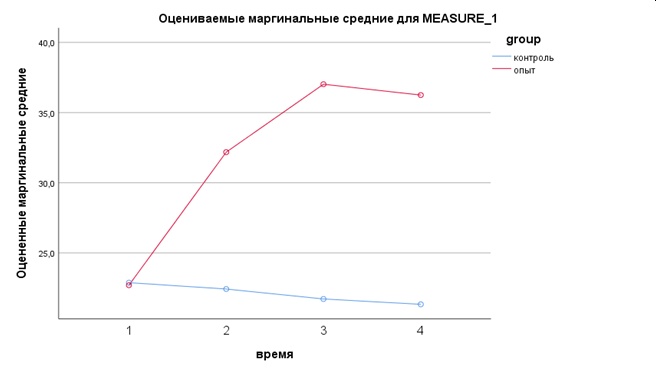
В начале эксперимента уровень гематокрита в опытной и контрольной группе находился ниже нормы; согласно критерию Манна-Уитни, различия между группами незначимы. В ходе эксперимента у пациентов опытной группы уже через 2 недели данный показатель пришел в норму и находился в ее пределах до конца срока наблюдения, тогда как в контрольной группе существенных изменений не было и до конца опыта показатель гематокритаоставался ниже нормы. Различия между группами статистически значимы, р=0,001. При этом наблюденная мощность многомерного критерия время*группа составила 98%.
Таблица 3. Результаты исследования показателя гемоглобина в крови у животных опытной и контрольной групп
Table 3. Hemoglobin levels in the blood of experimental and control animals
Гемоглобин | Норма | Опытная (n=10) | Контрольная (n=10) | Значимость, Р ANOVA/ Манна-Уитни |
Д0 (1) | 90…150 г/л | 82,480±9,235 | 85,190±6,200 | 0,01/0,739 |
2 недели (Д14) | 91,900±17,791 | 85,630±5,990 | 0,01/0,315 | |
4 недели (Д28) | 96,980±18,512 | 83,950±7,536 | 0,01/0,029 | |
6 недель (Д42) | 99,830±17,237 | 80,420±8,414 | 0,01/0,003 |
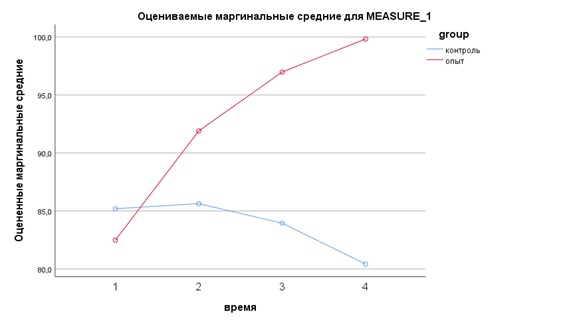
В начале эксперимента показатель гемоглобина в опытной и контрольной группах был ниже нормы; согласно критерию Манна-Уитни различия в группах незначимы. В ходе эксперимента данный показатель в опытной группе достиг нижней границы нормы уже через 2 недели, постепенно возрастая к концу срока наблюдения, тогда как в контрольной уровень гемоглобина оставался ниже нормы в течение всего эксперимента. Наблюденная мощность многомерного критерия время*группа составила 90,4%.
Таблица 4. Результаты исследования уровня креатинина в сыворотке крови у животных опытной и контрольной групп
Table 4. Serum creatinine levels in experimental and control animals
Креатинин | Норма | Опытная (n=10) | Контрольная (n=10) | Значимость, Р ANOVA/ Манна-Уитни |
Д0 (1) | 45…140 ммоль/л | 304,9±130,679 | 319,2±150,045 | 0,001/0,739 |
6 недель (Д42) | 255,1±115,544 | 325,8±159,562 | 0,001/0,143 |
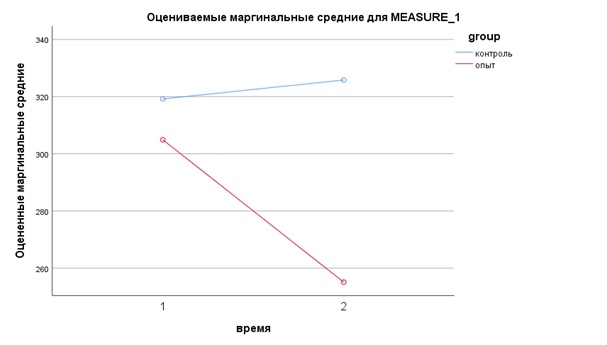
Уровень креатинина в сыворотке крови животных опытной и контрольной групп был и оставался стабильно высоким; согласно критерию Манна-Уитни, различия между группами незначимы. Наблюдаемые у пациентов в Д0 показатели креатинина соответствуют стадии III по классификации IRIS (умеренная ренальная азотемия). Однако в опытной группе в ходе эксперимента удалось значительно снизить его уровень. При этом наблюденная мощность многомерного критерия время*группа равна 96%.
Таблица 5. Результаты исследования уровня мочевины в сыворотке крови у животных опытной и контрольной групп
Table 5. Serum urea levels in experimental and control animals
Мочевина | Норма | Опытная (n=10) | Контрольная (n=10) | Значимость, Р ANOVA/ Манна-Уитни |
Д0 (1) | 4,0…8,5 ммоль/л | 16,700±6,499 | 13,7±3,780 | 0,075/0,247 |
6 недель (Д42) | 10,680±2,372 | 15,730±5,217 | 0,075/0,023 |
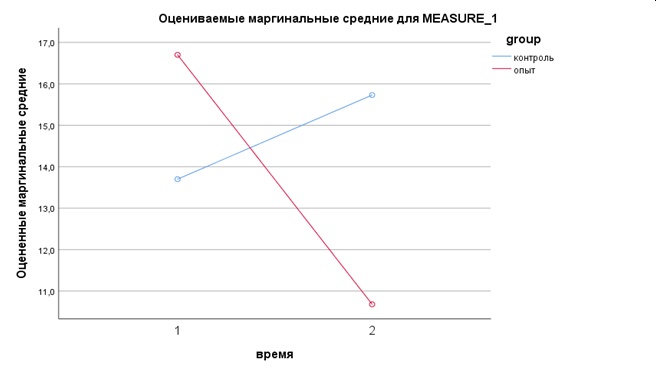
Уровень мочевины у животных опытной и контрольной группы был и оставался выше референсных значений на всем протяжении эксперимента; согласно критерию Манна-Уитни, различия в группах незначимы. Однако в опытной группе удалось добиться существенного снижения данного показателя с 16,70 до 10,68 ммоль/л к концу наблюдения, тогда как в контроле уровень мочевины на Д42 составлял 15,73 ммоль/л. Наблюдаемая мощность многомерного критерия время*группа составила 95%.
Результаты исследования уровня эритропоэтина (ЭПО)
Факт ЭПО дефицитной анемии у подопытных кошек, вызванной ХБП, ставился на основании снижения концентрации ЭПО ниже нормы, выведенной специально для данного исследования путем определения уровня ЭПО у 12 клинически здоровых кошек в возрасте от 1 до 5 лет обоего пола с ХБП 1 степени по классификации IRIS (патологические изменения, такие как протеинурия, гипостенурия и агранулоцитарная лейкоцитурия регистрируются у этих животных только в анализах мочи).
Оценку уровня ЭПО проводили на момент включения в КИ (Д0), затем на 14 (Д14) и 42 (Д42) дни. За референсный интервал нормальных значений принят уровень ЭПО, полученный при исследовании крови клинически здоровых кошек - от 9 до 38 мЕ /мл [36,38].
Исходный уровень ЭПО как в опытной, так и в контрольной группе был существенно ниже, чем у здоровых животных. В ходе эксперимента достигнуть нижней границы нормального значения не удалось, оцененные маргинальные показатели M±m составляли для контрольной группы 4,797±1,925, а для опытной 6,610±1,925. Наблюденная мощность многомерного критерия время*группа составила 15%. Полученные данные позволяют сделать вывод о том, что стимуляция показателей эритропоэза (повышение численности эритроцитов, увеличение показателя гематокрита и уровня гемоглобина), наблюдаемая под действием Гамавита, не связана со стимуляцией выработки эндогенного ЭПО.
Сравнительная оценка терапевтической эффективности двух схем лечения.
Таблица 6. Терапевтическая эффективность лечения кошек с ренальной анемией при ХБП III-IV стадии
Table 6. Therapeutic effectiveness of treatment of cats with renal anemia in III-IV stage of CKD
Признак | Опытная группа | Контрольная группа |
Общее клиническое состояние | ||
Новые осложнения в общем состоянии | Нет | Нет |
Усугубления признаков почечной недостаточности | Нет | Нет |
Анализ мочи | ||
снижение уровня протеинурии | Да | Да |
снижение тяжести гипостенурии | Да | Да |
Анализ крови | ||
повышение уровня ЭПО | Нет | Нет |
повышение показателя гематокрита | Да* | Нет |
повышение уровня гемоглобина | Да* | Нет |
повышение количества эритроцитов | Да* | Нет |
снижение уровня анизоцитоза эритроцитов | Да* | Нет |
повышение средней концентрацииHb в эритроцитах | Да* | Нет |
повышение среднего объема эритроцитов | Да* | Нет |
повышение среднего содержанияHb в эритроците | Да* | Нет |
снижение содержания креатинина в сыворотке крови | Да | Нет |
снижение содержания мочевины в сыворотке крови | Да | Нет |
* через 2 недели эксперимента
Ренальная анемия – одно из многочисленных осложнений ХБП у кошек, значимо снижающее качество жизни животных. Ренальная анемия, как правило, развивается у пациентов с тяжелыми деструктивными изменениями почечной паренхимы (обычно это процессы склерозирования не менее 75% органа). По мере прогрессирования заболевания почек имеется потеря клеток почек, способных вырабатывать эритропоэтин. Развивается анемия, которая может усугубляться кровопотерей и укороченным сроком жизни эритроцитов вследствие уремического синдрома [14].В подавляющем числе случаев нозологической формой нефропатии, приведшей к этому типу анемии, является именно ХБП [13,29]. Ведущими механизмами развития и стойкости ренальной анемии являются:
- недостаточность эндогенного эритропоэтина: как абсолютный дефицит этого гормона (снижение выработки почками), так и выраженное уменьшение активности его рецепторных взаимодействий (относительный дефицит);
- сокращение срока жизни эритроцитов, во многом связанное с уремической интоксикацией; а уровень гемолиза, значительно превосходящий физиологическую норму (у здоровых животных в сутки разрушается/регенерируется не более 2% эритроцитов), не толькозначимый этиологический фактор развития анемии, но и одна из причин, усугубляющих почечное поражение, поскольку гемоглобин, попадающий в первичную мочу, вызывает канальцевую деструкцию/дисфункцию, и без того являющуюся неотъемлемой частью патогенеза ХБП;
- нарушение обмена железа, фолиевой кислоты и цианокобаламина в организме больных животных [13,14,36].
Анемия неизбежно приводит к развитию гипоксии тканей и органов, а также к снижению общей и специфической резистентности организма, при этом почки страдают от гипоксии достаточно серьезно, так как процессы реабсорбции в канальцевом аппарате этого органа требуют больших затрат кислорода и энергии. Таким образом, хроническая анемия приводит к усугублению тяжести ренальной гипертензии и других признаков, поэтому поиск средств, способных влиять на качественные и количественные показатели красной крови, при этом не обладающих нефротоксическими свойствами, является актуальной клинической проблемой [13].
Отечественные ветеринарные специалисты уже располагают успешным опытом применения Гамавита для коррекции анемии и детоксикации организма при ХБП [3,4,20].В данных работах показано, что использование Гамавита способствовало как восстановлению красного ростка кроветворения, так и снижению повышенного уровня креатинина и мочевины в сыворотке крови кошек и собак. Немаловажно, что Гамавит также повышает естественную резистентность организма, стимулируя активность естественных киллеров и другие показатели [2,5-7,9,12,17,22].
В настоящем КИ использование в течение 14 дней в процессе исследования Гамавита в экспериментальной группе привело к существенному улучшению большинства показателей красной крови, что является следствием стимулирующего влияния препарата на костномозговое кроветворение. Уже в Д14 отмечено возращение к норме численности эритроцитов, показателя гематокрита и уровня гемоглобина. Ранее различными исследователями было показано, что Гамавит лечит анемию и восстанавливает эритроидный росток гемопоэза при стрессе [5], врожденном дефиците железа [6], кровепаразитарных заболеваниях и гельминтозах собак [1,12,22,24], кошек [1,17,26,40], северных оленей [15,28] и других животных [16], при экспериментальном токсикозе, вызванном антипаразитарными препаратами [21]. ТакжеГамавит стимулирует эритропоэз при макроцитарной анемии, вызванной фенилгидразином[27], для которой характерен анизо – и пойкилоцитоз, уменьшение концентрации гемоглобина и количества эритроцитов [11].Поскольку механизм развития токсической анемии под действием фенилгидразина связан с блокадой связывания ЭПО с рецепторами, приводящей к нарушению сигнального пути JAK-STAT и подавлению созревания эритроцитов [37], можно предположить, что активные компоненты Гамавита воздействуют на JAK-STAT, повышая эффективность связывания ЭПО с рецепторами.
Поскольку в данном КИ показано, что Гамавит не способствует выработке эндогенного ЭПО при ренальной анемии, механизм стимуляции красного ростка кроветворения (численности эритроцитов, уровня гемоглобина и показателя гематокрита) скорее всего связан с ранее выявленной в эксперименте способности активных компонентов препарата стимулировать пролиферацию стволовых кроветворных клеток и/или ранних эритроидных предшественников [27].
Имеются данные, согласно которым подавлению эритропоэза, которое клинически проявляется эритропенией и анемией, может способствовать высокий уровень мочевины в крови[29].В нашем КИ уровни креатинина и мочевины у пациентов опытной и контрольной группы были и оставались выше референсных значений на всем протяжении эксперимента, однако в группе с применением Гамавита удалось добиться существенного снижения данных показателей.Креатинин и мочевина постоянно продуцируются в организме, в связи с чем они являются одними из самых доступных для врачей в рутинной практике маркеров, указывающих на нарушение функции почек.
Важно отметить, что несмотря на то, что уровни мочевины и креатинина не достигли нормы на Д42, качество жизни животных в опытной группе резко улучшилось, что может быть связано с системным снижением интоксикации организма животного. В ряде других работ с применением Гамавита также наблюдалась нормализация данных показателей [2-4,12,18,20,27].Снижение показателейуремической интоксикации под действием Гамавита также может способствовать стимуляции красного ростка гемопоэза, поскольку при данной интоксикации срок жизни эритроцитов может сокращаться [33, 35].
Поскольку в процессе данного КИу Гамавита не было выявлено каких-либо нефротоксичных свойств и нежелательных взаимодействий с препаратами стандартной нефропротективной терапии, то он может быть рекомендован одним из препаратов первого выбора для лечения ХБП III – IV стадий у кошек.
ЗАКЛЮЧЕНИЕ
Результаты проведенного КИ у кошек с ЭПО дефицитной анемией на фоне ХБП III-IV стадии продемонстрировали эффективность использования Гамавита для стимуляции эритропоэза.
Гамавит может быть рекомендован к широкому использованию у кошек в качестве одного из патогенетических, симптоматических и лечебно-профилактических средств в комплексной терапии ХБП на доклинических и клинических этапах заболевания.
Поскольку ХБП является хроническим и неуклонно прогрессирующим заболеванием, рекомендовано дальнейшее исследование лечебно-профилактических свойств препарата Гамавит в терапевтических схемах, длительностью более 2-х недель и у пациентов с ХБПIII-IVстадии.
ВЫВОДЫ
- Препарат Гамавит в рекомендованных производителемдозах достоверно повышает количество эритроцитов, уровень гематокрита и гемоглобина.Таким образом, Гамавит:
- проявляет антиишемические и антигипоксантные свойства;
- повышает объем щелочного буфера крови и профилактирует развитие дыхательного и канальцевого ацидоза;
- уменьшает выраженность ряда клинических проявлений у пациентов с ХБП, связанных с дыхательной и сердечной недостаточностью;
- Восстановление физиологически обусловленного уровня гематокрита в организме пациентов с ХБП III-IV стадии на фоне применения Гамавита привело к улучшению их общего состояния и регрессу ряда клинических проявлений.
- Гамавит не обладает нефротоксическими свойствами у кошек с ХБП III-IV стадиии снижает показатели уремической интоксикации.
Конфликт интересов
Авторы заявляют о существовании конфликта интересов. А.В. Санин, А.Н. Наровлянский и А.В. Пронин являются разработчиками лекарственного препарата Гамавит®.
СПИСОК ЛИТЕРАТУРЫ
1.Анников В.В., Красников А.В., Санин А. В. Эффективность Гамавита при проведении дегельминтизации котят и щенков. Ветеринарная клиника. 2018а. N 5. С.24-25
2.Анников В.В., Анникова Л.В., Санин А.В., Наровлянский А.Н., Пронин А.В., Санина В.Ю., Кожевникова Т.Н. Эффективность гамавита при терапии боррелиоза у собак. Ветеринария Кубани 2018б N4 С.15-18.
3.Анников В.В., Анникова Л.В., Кольдяева М.А., Платицына Е.С. Оценка терапевтической эффективности гамавита в составе комплексной терапии при лечении кошек на второй азотемической стадии хронической почечной недостаточности. Труды Всероссийского НИИ экспериментальной ветеринарии им.Я.Р.Коваленко 2018.Т.80 N 2. С. 14-17
- Бакулина Е. А. Случай терапии хронической почечной недостаточности у кошек. Труды Всероссийского НИИ экспериментальной ветеринарии им.Я.Р.Коваленко. 2018. Т.80 N 2. С. 36–39.
5.Вишневская Т.Я., Абрамова Л.Л. Сравнительный анализ гематологических показателей крови при стрессе и его иммунокоррекция препаратом гамавит.В сб.: Актуальные вопросы ветеринарной медицины материалы одиннадцатой Сибирской ветеринарной конференции. 2012 С. 59-60.
6.Глаголева Т.И., Завалишина С.Ю., Медведев И.Н.Ферроглюкин и гамавит в коррекции антиагрегационных свойств сосудов у новорожденных телят с дефицитом железа. Успехи современного естествознания. 2013. N 5. С. 17.
7.Григорьева Е.А., Пронин А.В., Санин А.В., Наровлянский А.Н., Тимофеева Т.Ю., Санина В.Ю., Степанова Т.Н., Герасимова Е.В., Иванова А.М., Кожевникова Т.Н. Воздействие препарата гамавит на активность естественных киллерных клеток. Ветеринария Кубани. 2016 N4 C.27-28.
8.Гришина Е.А., Еровиченков А.А. Биохимическое обоснование применения комплексной терапии в острой фазе экспериментальных гельминтозов животных. Журнал инфектологии 2017 т.9 N 3 С. 32-39
9.Гришина Е.А. Исследование активности окислительного стресса у животных в острой стадии гельминтоза и на фоне терапии. Ветеринария, зоотехния и биотехнология. 2017 N 10 С.84-90
- Зарипова Т.Е., Бакулина Е.А., Жавнис С.Э. Острое отравление у собаки: клинический случай. Ветеринарная клиника 2017, N 8, C.10-12
11.Козловская К.С., Киланова М.В., Мамаева Е.А., Косарева П.В., Самоделкин Е.И. Сравнительная характеристика костномозгового кроветворения и состава периферической крови при моделировании приобретенной токсической гемолитической анемии 2-бутоксиэтанолом и фенилгидразином. Актуальные проблемы медицины в России и за рубежом. Сборник научных трудов. Новосибирск. 2016. С. 68-71
12.Леонард Р.А. Влияние гамавита, фоспренила и максидина на ряд биохимических показателей крови собак, больных пироплазмозом. Ветеринарная клиника. 2006. N 3 C.2–5
13.Леонард Р.А., Рекомендации НАВНУ: Хроническая болезнь почек у собак и кошек – основополагающие принципы диагностики и скрининга. http://vetnefro.ru/?r=pub&one=60
14.Леонард Р.А. Ренальная анемия: особенности этиопатогенеза и методы коррекции. Современная ветеринарная медицина. 2017 N1. C.38 – 43.
- Либерман Е.Л., Георгиу Х., Белименко В.В. Опыт применения гамавита при лечении кровепаразитарных болезней северных оленей. Российский ветеринарный журнал. СХЖ. 2014. N 4. С. 31-33.
16.Обрывин, В.Н.,Жоров Г.А., Рубченков П.Н. Влияние препаратов гамавит и гала-вет на токсический иммунодефицит у белых крыс. Ветеринарная патология. 2008. N 3. С.119-125.
17.Переслегина И.О., Кожевникова Т.Н. Эффективность применения гамавита при токсокарозе у кошек. Известия Оренбургского аграрного университета. 2018 N6(74). С.162-163.
18.Переслегина И.О., Дубровина Т.С., Клинцова Т.Ю., Зотова С.Н., Кожевникова Т.Н., Санин А.В. Клинические случаи хронического отравления кошек: опыт применения препарата Гамавит. Ветеринария Кубани. 2017 N5. С.23 – 26.
19.Переслегина И.О. Эффективность гамавита при отравлении кошки ивермектином. Школа науки. 2018 N 6 С.14-15.
- Савойская С.Л., Кожевникова Т.Н., Санина А.А. Применение гемостимулятора и детоксиканта при лечении собак на III азотемической стадии хронической почечной недостаточности. Европейское научное объединение 2019 N9-2 (55) с.116-117.
21.Саличев А.В., Ожерелков С.В., Изместьева А.В., Виденина А.А., Санин А.В. Рандомизированное контролируемое двойное слепое исследование антитоксического действия гамавита и гамавитфорте в эксперименте invivo с применением Имидокарба дипропионата. Ветеринария Кубани 2011 N 6 с.22-25.
- Самойлова Е.С., Дерхо М.А. Из опыта применения антиоксидантов в комплексной схеме лечения бабезиоза собак.Ветеринарный врач. 2009. N 1. С. 13-16.
23.Санин А.В. Гамавит – эффективное средство при экстракорпускулярных анемиях. Ветеринарная клиника 2009. N4 С.16-19
- Санин А.В., Сосновская О.Ю., Санина В.Ю., Кожевникова Т.Н., Васильев И.К., Наровлянский А.Н., Пронин А.В. Особенности применения иммуномодуляторов при паразитарных инвазиях. Ветеринария Кубани 2010 N 2.С.15-18.
- Санин А.В., Ожерелков С.В., Сосновская О.Ю., Наровлянский А.Н., Пронин А.В. Протективный эффект Гамавита при острой интоксикации, вызванной четыреххлористым углеродом в эксперименте. Российский ветеринарный журнал.СХЖ. 2015. N 2. С. 40-42.
- Санин А.В., Наровлянский А.Н., Пронин А.В. Кожевникова Т.Н., Агафонова А.Д., Анникова Л.В., Анников В.В., Гамавит повышает эффективность терапии гемобартонеллеза (гемоплазмоза) у кошек: контролируемое исследование. Российский Ветеринарный Журнал. 2017 N 3. С.28-32
27.Санин А.В., Наровлянский А.Н., Пронин А.В., Кожевникова Т.Н., Сосновская О.Ю., Жавнис С.Э., Ожерелков С.В., Климова Д.А. Гамавит для коррекции токсической гемолитической анемии и стимуляции эритропоэза. Ветеринария. 2018. N 10 с.54-59
28.Сибен А.Н., Либерман Е.Л., СиливановаЕ.А.Влияние иммуномодуляторов и антгельминтиков на состояние крови северных оленей. Вестник ветеринарии. 2015. N 3 (74). С. 64-69.
29.Данн М.Дж. Почечная эндокринология. (Перевод с англ. В. И. Кандрора). М. Медицина, 1987.672 с.
- Chalhoub S., Langston C.E., Farrelly J. The Use of Darbepoetin to stimulate erythropoiesis in anemia of kidney disease in cats: 25 Cases. J. Vet. Intern. Med.2012; 26(2):363-9
31.Chikazawa S., Dunning M. A review of anaemia of inflammatory disease in dogs and cats. Journal of Small Animal Practice 57(7):348-353. DOI: 10.1111/jsap.12498
32.Cowgill L.D., James K.M., Levy J.K., Browne J.K., Miller A., Lobingier R.T., Egrie J.C. Use of recombinant human erythropoietin for management of anemia in dogs and cats with renal failure. J Am Vet Med Assoc. 1998 Feb 15;212(4):521-8.
- Elliot J., Barber P.J. Feline chronic renal failure: clinical findings in 80 cases diagnosed between 1992 and 1995. J Small AnimPract 1998;39.78-85
- Erslev AJ, Besarab A.Erythropoietin in the pathohologenesis and treatment of the anemia of chronic renal failure. Kidney Int.1997;51:622-630.
- Grauer G.F. Treatment Guidelines for Chronic Kidney Disease in Dogs & Cats: International Renal Interest Society Recommendations. http://iris-kidney.com/pdf/IRIS_Staging_of_CKD_modified_2019
- Nephrology and urology of small animals / edited by Joe Bartges, David J. Polzin. Willey-Blackwell, 2011.
- Pandey K., Meena A.K., Jain A., Singh R.K. Molecular mechanism of phenylhydrazine induced haematotoxicity: a review. American Journal of Phytomedicine and Clinical Therapeutics. 2014 v.2 N3 p.390-394
- Pechereau D., Martel P., Braun J.P. Plasma erythropoietin concentrations in dogs and cats : reference values and changes with anaemiaand/or chronic renal failure. Res.Vet.Sci. 1997. Vol.62, Issue 2, 185-188.
- Sanderson S.Use of Erythropoietin and Calcitriol for Chronic Renal Failure in Dogs and Cats WSAVA World congress proceedings, 2005.
- https://zoosecrets.ru/anemiya-u-koshek-lechenie-preparaty.
Резюме
Ренальная анемия – одно из частых осложнений хронической болезни почек (ХБП) у кошек, значимо снижающее качество жизни животных.Чаще всего механизм развития ренальной анемии связан с недостаточностью эндогенного эритропоэтина (ЭПО), или с сокращением срока жизни эритроцитов, вызванным уремической интоксикацией. Поскольку анемия приводит к усугублению тяжести ренальной гипертензии и других симптомов ХБП, особую актуальность приобретает поиск эффективных лекарственных средств, способных стимулировать эритропоэз при ХБП и при этом не обладающих нефротоксическими свойствами.
Цель работы состояла в изучении эффективности подключения к схеме лечения кошек с ХБП Гамавита – комплексного препарата, действующими веществами которого являются иммуностимулятор - нуклеинат натрия и экстракт плаценты денатурированной.
В исследование были включены 20 кошек разных пород в возрасте от 5 до 16 лет с ХБП III-IV стадии по классификации IRIS, сопровождающейся анемией и снижением показателя гематокрита от 25 и до 16%. Пациентов распределили на 2 равных группы - контрольную (n=10) и опытную (n=10) в случайном порядке с помощью метода блочной рандомизации. В контрольной группе использовали стандартную нефропротективную схему терапии. В опытной группе дополнительно применяли «Гамавит®, раствор для инъекций 10 мл». Гамавит вводили в дозе 0,5 мл/кг 1 раз в сутки, в одно и то же время. Общий курс составил 14 дней (7 дней в/в и 7 дней п/к).
Условия кормления и содержания животных опытной и контрольной групп были идентичными. Для кормления использовали стандартизированный серийный корм – PurinaCatChowAdult с курицей/индейкой/лососем. Доступ к питьевой воде – adlibitum.
По окончании исследования оценка терапевтической эффективности проводилась комплексно с учетом данных клинического осмотра, результатов общего и биохимического анализов крови. Дополнительно оценивали наличие побочных эффектов.
Исходная численность эритроцитов, а также показатель гематокрита и уровень гемоглобина в опытной и контрольной группах были на нижней границе нормы либо ниже референсных значений. В ходе эксперимента у животных опытной группы уже через 2 недели данные показатели пришли в норму, тогда как в контрольной группе существенных изменений не было. Статистически значимая разница между опытной и контрольной группами сохранялась до конца наблюдения (р=0,001).
Уровни креатинина и мочевины в сыворотке крови животных обеих групп были и оставались стабильно высокими, однако в опытной группе в ходе эксперимента удалось добиться существенного снижения данных показателей.
Исходный уровень ЭПО в обеих группах был существенно ниже, чем у здоровых животных. В ходе эксперимента достигнуть нижней границы нормального значения не удалось, что позволяет сделать вывод о том, что стимуляция показателей эритропоэза в опытной группе, наблюдаемая под действием Гамавита, не связана со стимуляцией выработки эндогенного ЭПО.
Таким образом, в ходе исследования выявлено, что Гамавит стимулирует эритропоэз у кошек с ХБП III-IV стадией, а именно, достоверно повышает количество эритроцитов, уровень гематокрита и гемоглобина проявляя. Этот эффект в совокупности с также выявленным снижением показателей уремической интоксикации (уровней креатинина и мочевины) приводит к улучшению общего состояния пациентов и регрессу ряда важных клинических проявлений.
Поскольку в процессе данного КИ у Гамавита не было выявлено каких-либо нефротоксичных свойств и нежелательных взаимодействий с препаратами стандартной нефропротективной терапии, то он может быть рекомендован к широкому использованию у кошек в качестве одного из патогенетических, симптоматических и лечебно-профилактических средств в комплексной терапии ХБП на доклинических и клинических этапах заболевания.
Summary
Renal anemia is one of the most common complications of chronic kidney disease (CKD) in cats, which significantly reduces theirlife quality. Most often, the mechanism of renal anemia development is associated with insufficiency of endogenous erythropoietin (EPO), or with a reduction in the life of red blood cells caused by uremic intoxication. Since anemia increases the severity of renal hypertension and other CKD symptoms, the search for effective drugs that can stimulate erythropoiesis in CKD and do not have nephrotoxic properties is particularly relevant.
The aim of the work was to study the effectiveness of Gamavit in the treatment regimen for cats with CKD compared with the standard treatment protocol. Active ingredients of Gamavit are sodium nucleinate and denaturatedplacenta extract.
The study included 20 cats of different breeds aged from 5 to 16 years with CKD stage III-IV according to the IRIS classification, accompanied by anemia and a decrease in hematocrit in the range from 25 to 16%. Patients were randomly divided into 2 equal groups - control (n=10) and experimental (n=10) using the block randomization method. In the control group a standard nephroprotective therapy regimen was used. In the experimental groupGamavit was added to the standard regimen. Gamavit was administered at a dose of 0.5 ml/kg 1 time per day, at the same time, during 14 consecutive days (7 days i/v and 7 days s/c).
The conditions for feeding and keeping animals of the experimental and control groups were identical. For feeding, we used a standardized serial diet -Purina CatChow Adult with chicken/turkey/salmon. Access to drinking water-ad libitum.
The initial number of red blood cells, as well as the hematocrit index and hemoglobin level in the experimental and control groups were at the lower limit of the norm or below the reference values. During the study, in the experimental group of the patients, these indicators returned to normal after 2 weeks, while in the control group there were no significant changes. The statistically significant difference between the experimental and control groups remained until the end of the observation (p=0.001).
Levels of creatinine and urea in the blood serum of the patients of both groups consistently high throughout the study, but in the experimental group a significant decrease in these indicators was found.
The initial level of EPO in both groups was significantly lower than in healthy cats. During the experiment, it was not possible to reach the lower limit of the normal value, which allows us to conclude that the stimulation of erythropoiesis indicators in the experimental group, observed under the influence of Gamavit, is not associated with the stimulation of endogenous EPO production.
Thus, the study revealed that Gamavit stimulates erythropoiesis in cats with CKD stage III-IV, significantly increasing the number of red blood cells, and the levels of hematocrit and hemoglobin. This effect, combined with a decrease in uremic intoxication values (creatinine and urea levels), lead to an improvement in the general condition of patients and regression in a number of important clinical manifestations.
Since no nephrotoxic effects and undesirable interactions with drugs of standard nephroprotective therapy were detected in the process of this study, Gamavit can be recommended for widespread use in cats as one of the pathogenetic, symptomatic, and therapeutic and prophylactic drugs in the complex therapy of CKD at the preclinical and clinical stages of the disease.